 |
 |
|
 |
寄付講座 臨床遺伝学研究室では、遺伝性難病、特にリソソーム病(ライソゾーム病)の研究を行っています。
本研究室における研究活動の概要をご紹介します。 |
研究項目
1.ファブリー病の分子病態解明とデータベース構築
2.ファブリー病と薬剤誘発性リソソーム病
3.ファブリー病のバイオマーカーの探索
4.ファブリー病に対する新しい治療薬の開発
5.その他のリソソーム病の研究
1.ファブリー病の分子病態解明とデータベース構築
ファブリー病は、α-ガラクトシダーゼA(GLA)の活性低下によって起こる遺伝病です。ヒトの体を構成する細胞内には、リソソーム(別名 ライソゾーム)と呼ばれる膜で囲まれた小器官があり、内部環境のpHが酸性に維持されています。そして、リソソーム内には酸性条件下で働く沢山の加水分解酵素が存在して、細胞内で不用になった物質の分解を担っています。GLAは、このようなリソソーム酵素のひとつであり、グロボトリアオシルセラミド(Gb3)などの糖脂質を分解する役割をはたします。ファブリー病の場合、GLAの働きが低下するため、Gb3などの糖脂質が分解されずに体内に蓄積して、様々な臓器の障害を来たします。
GLAをコードするGLA遺伝子はX染色体に存在するため、ファブリー病は、X染色体連鎖の遺伝型式をとります。典型的な臨床経過をとる「古典型ファブリー病」の男性患者さんでは、少年期から青年期にかけて、手足の痛み、低汗症、被角血管腫や角膜混濁などの症状がみられ、成人期になると腎障害、脳血管障害や心障害が進行します。消化器障害、聴覚障害や呼吸障害が出現することもあります。また、少年期や青年期には症状がみられず、成人期になってはじめて腎障害や心障害が出現する「遅発型ファブリー病」の男性患者さんもいます。一方、ファブリー病の女性は、ひとつの体細胞内に2本あるX染色体のうちの片方に病気の遺伝子があるため「ファブリー病ヘテロ接合体」と呼ばれます。こうした女性では、X染色体のランダムな不活化の影響を受けて、無症状の方から重症の方まで多様な臨床像を示します。
私たちは、こうしたファブリー病の病態を明らかにするため、GLA遺伝子やGLA蛋白質の解析を行っています。これまでに多くのファブリー病の原因遺伝子変異や機能的多型(E66Qなど) を同定すると共に、こうした遺伝子の変化がGLA蛋白質の構造に影響を与え(図1), さらには、それがGLA活性低下を来たして(図2)、多様な臨床像に結びつく機序について研究しました。そして、その情報をファブリー病データベース(http://fabry-database.org/)にまとめて公開しています(参考文献:Mol Genet Metab Rep, 17: 73-79, 2018; PLOS ONE, 8: e84267, 2013)。
図1. GLAの構造変化と臨床表現型
それぞれ、M72R(左上)、M72I(右上)およびM72V(左下)の遺伝子変異によって起こるGLAの構造変化をin silico で推測したものです。GLAの全体構造を灰色のスティックモデルで、アミノ酸置換により影響を受ける原子を球モデルで示しています。変化の大きさが球の色で表されます。GLA蛋白質を構成するアミノ酸の位置が同じ(ここでは、72番目のアミノ酸で、野生型ではメチオニンに相当)でも、M72RやM72Iのような遺伝子変異によるアミノ酸置換では大きな構造変化を来たして、臨床表現型が古典型ファブリー病となります。一方、M72VではGLA の構造変化が小さく、遅発型ファブリー病になることがわかります。
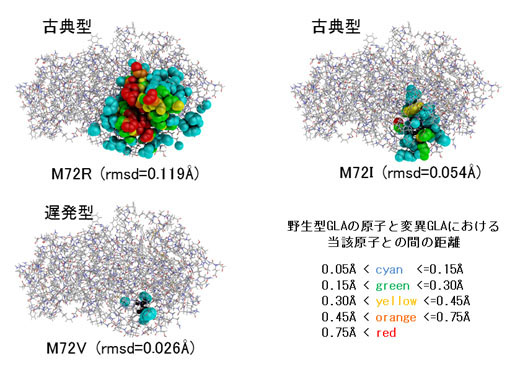
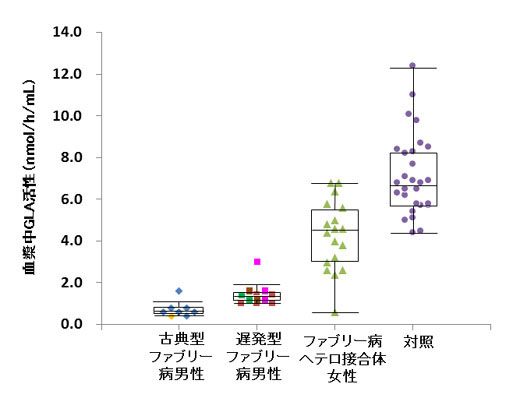
図2. 血漿中のGLA活性測定結果
古典的ファブリー病男性では、GLA活性が著明に低下するのに対し、遅発型ファブリー病男性の多くは僅かながら残存活性が認められます。一方、ファブリー病ヘテロ接合体の女性のGLA活性は、極めて低いものから、対照と区別出来ない程高いものまで多様です。
2. ファブリー病と薬剤誘発性リソソーム病
ファブリー病では、腎臓や心臓などの臓器・組織を構成する細胞のリソソーム内に糖脂質が蓄積し、電子顕微鏡で観察すると層状封入体や高電子密度小体の所見が認められます。この様な特異的な病理像はファブリー病の診断において極めて重要な所見とされて来ました。しかし、近年になり、抗マラリア薬および膠原病治療薬のヒドロキシクロロキンや抗不整脈薬のアミオダロンなどの陽イオン性両親媒性薬物(CADs)(図3)の投与により、ファブリー病との鑑別が困難な病理像を呈する薬剤誘発性リソソーム病が発生し、しばしば誤診を招く原因となることが報告されています。ファブリー病およびCADsによる薬剤誘発性リソソーム病では、リソソーム内に蓄積する物質が、前者では主にGb3、後者ではリン脂質と異なりますが、両者の分解代謝の場が同じリソソームであることから、CADsの投与によりリソソームでのGb3分解代謝障害が増強され、ファブリー病の病態が悪化するのではないかと懸念されています。特にアミオダロンは、ファブリー病の患者さんに対して、しばしば使用される薬なので、ファブリー病患者さんの治療にあたる方たちにとって重要な問題です。
本研究室では、野生型およびファブリー病モデルマウスに対してアミオダロンやヒドロキシクロロキンを投与し、肝臓、腎臓および心臓のGLA活性やGb3含有量について調べました。その結果、これらのCADsを投与した場合、野生型マウスの臓器におけるGLA活性やファブリー病モデルマウスの臓器におけるGb3の蓄積量は、薬物を投与しない場合と変わらないことが示されました。今後、マウスとヒトとの違いや薬剤の投与量やその方法などに関して更に検討する必要がありますが、これらの動物を用いた実験では、CADsの投与によるGb3の分解代謝への大きな影響はみられないことが示唆されました(参考文献:Mol Genet Metab Rep, 28: e100773, 2021)。
図3. ヒドロキシクロロキンとアミオダロンの構造
3.ファブリー病のバイオマーカーの探索
ファブリー病の診断や治療効果の判定には、バイオマーカーが役立ちます。ファブリー病のバイオマーカーとして、これまで、体内への主要な蓄積物質であるGb3の血漿中濃度の測定値が用いられてきました。しかし、Gb3は、非患者さんの血漿中にもかなりの量が存在し、遅発型ファブリー病の男性患者さんや多くのファブリー病ヘテロ接合体女性患者さんの血漿中Gb3の値は、非患者さんのそれと区別がつきません。
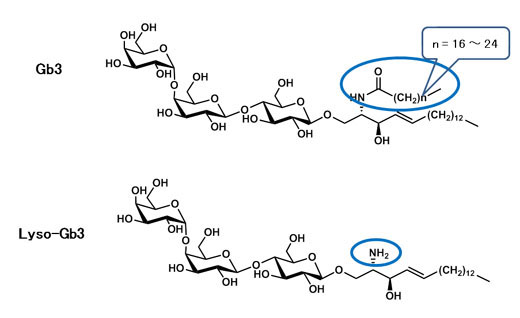
そこで、Gb3よりも優れたファブリー病バイオマーカーがないか、探索しました。そして、Gb3を構成する脂肪酸の部分が脱落した形の構造を持つグロボトリアオシルスフィンゴシン(Lyso-Gb3)に注目しました(図5)。Lyso-Gb3は、生体内では、ごく微量しか存在せず、僅かでも体内に蓄積すると、平滑筋の増殖、血管壁の肥厚、TGF-β1の発現促進、腎臓のタコ足細胞の障害や細胞外マトリックスの増加を起こすと考えられています。
液体クロマトグラフィー-タンデム型質量分析(LC-MS/MS)法で血漿中のLyso-Gb3を測定すると、ごく一部の特殊な遺伝子変異を持つ患者さんを除く殆どのファブリー病患者さんで、健常者や機能的多型(E66Q)を持つ方に比べて高い値が得られました。また、組換えGLAを用いた酵素補充治療を行うと、これらの値が低下することも明らかになりました(参考文献:Clin Exp Nephrol, 22: 843-849, 2018)。
私たちは、この様なバイオマーカーの測定がファブリー病患者さんの診断や治療評価にも役立つよう、研究を進めています。
図4. Gb3とLyso-Gb3の構造
4.ファブリー病に対する新しい治療薬の開発
ファブリー病に対する治療として、現在、組換えGLAを2週間に1回の頻度で静脈内に点滴投与する酵素補充療法が行われています。組換えGLAは、ヒトのGLA遺伝子に基づく酵素をヒト由来培養線維芽細胞やチャイニーズハムスター卵巣由来の細胞(CHO細胞)で発現し、生産したものが使用されます。酵素補充療法の導入により、臓器障害が進行する前に治療を開始すれば、病気の進行阻止に大きな効果があることが報告されています。
しかし、ファブリー病の男性患者さんの多くは、体内にGLAを持っていません。そのため、こうした方たちの場合、組換えGLAを繰り返し投与すると、組換えGLAに対する抗体が産生されてアレルギー性有害副反応がみられたり、治療効果が減弱することがあることも明らかになりました。
私たちは、α-N-アセチルガラクトサミニダーゼ(NAGA)という酵素に注目しました。この酵素は、α-ガラクトシダーゼBとも呼ばれ、Gb3やLyso-Gb3を分解する機能は持っていませんが、その立体構造は、GLAによく似ていて、GLAよりも安定です。そこで、私たちはGLA分子を構成するアミノ酸のうち、基質認識に係る203番目のグルタミン酸と206番目のロイシンに相当するNAGAのアミノ酸を調べた所、それらは、188番目のセリンと19番目のアラニンであることがわかりました。私たちは、NAGAの188番目のセリンをグルタミン酸に、191番目のアラニンをロイシンに置換した改変型NAGAを分子設計し(図5)、それをCHO細胞で大量生産する系を作りました。出来上がった改変型NAGAは、Gb3やLyso-Gb3を分解する機能を獲得し、GLAに比べて大変安定でした。また、GLAとは免疫原性も異なることが示されました。この改変型NAGAをファブリー病モデルマウスに投与すると、肝臓、心臓や腎臓に蓄積していたGb3などの糖脂質が減少することがわかりました。ファブリー病の患者さんは、もともと体内にNAGAを持っていることから、改変型NAGAを投与してもそれに対する抗体を作りにくく、また、安定性が高いことから体内で活性が持続することも期待されます。また、改変型NAGAを利用した遺伝子治療や細胞治療の研究も始まっています。 今後、さらに改善を加えて、ファブリー病の新規治療薬開発に向けて努力したいと考えています(参考文献:Am J Hum Genet, 85: 569-580, 2009)。
私たちは、酵素補充療法以外にも、低分子化合物によるファブリー病治療のための基礎研究も行っています。現在では、基質アナログを変異酵素に結合させ、そのリソソームへの輸送過程における安定化を目指すシャペロン治療薬が導入されています。私たちは、シャペロン治療薬候補となる低分子化合物の酵素への結合と解離について、表面プラズモン共鳴(SPR)や等温滴定カロリメトリー(ITC)などの物理化学的解析法により、調べました。また、両者の結合様式についても、様々な構造学的方法を利用して調べています。これらの解析結果から、より優れたファブリー病治療薬の開発を目指したいと思います(参考文献:Mol. Genet Metab, 96: 233-238, 2009)。
図5. GLA, NAGAおよび改変型NAGAの立体構造
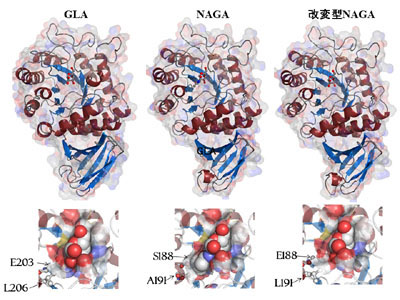 |
図の上部は全体構造(酵素をリボンモデルで、基質をスティックモデルで示している)を、図の下部はそれぞれの酵素の活性部位(基質が結合した状態)を示す。 |
5.その他のリソソーム病の研究
私たちは、ファブリー病以外のリソソーム病をも対象として、分子遺伝学、生化学や構造生物学的視点から研究を行っています。(参考文献:J Hum Genet, 53: 467-474, 2008; J Hum Genet, 54: 324-330, 2009; Proc Natl Acad Sci U S A, 110: 14628-14633, 2013; PLOS ONE, 11: e0163964, 2016; Hum Mutat, 39: 1788-1802, 2018)。
|
 |
|
|
|
|
|
|
|
|