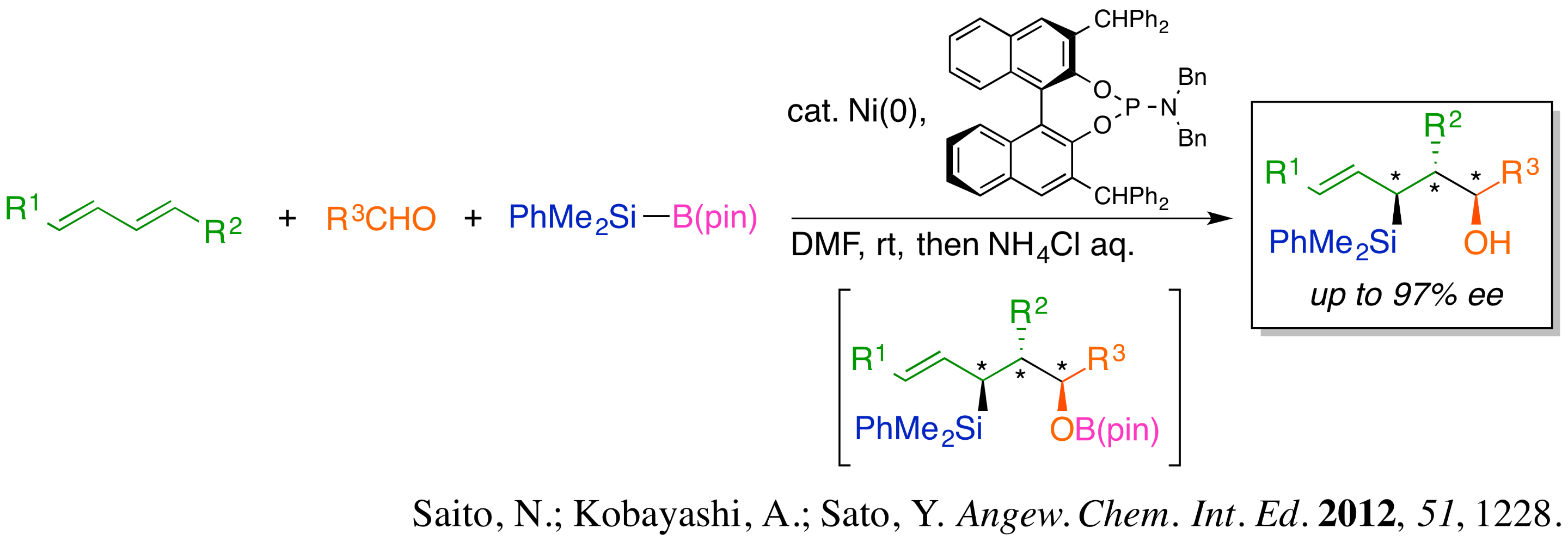
当研究室の研究内容
医薬品を始めとする生物活性化合物の多くは炭素を含む有機化合物です。言うまでもなく、有機化合物は「炭素と炭素」、「炭素とヘテロ元素(酸素や窒素など)」どうしが結合することによって基本骨格を形成します。
従って、それらの結合を以下にうまく形成させることができるかが、標的とする有機化合物を効率的に合成するための鍵となります。特に、有機化合物のメインの骨格は炭素-炭素結合で形成されます。これまで効率的な炭素-炭素結合形成のための新しい反応の開発が盛んに行われてきました。
私たちは特に、遷移金属錯体を用いた新しい炭素-炭素形成反応の開発とその応用に関する研究を進めてきました。その中でも特に、遷移金属錯体の特徴的な性質である多重結合の活性化を機軸として、アルケンやアルキンなどの炭素-炭素多重結合性化合物を基盤とする触媒的分子変換反応の開発研究を行ってきました。以下に、これまでの主な研究成果を紹介致します。
・アレンを基盤とする新しい環状化合物合成法の開発
・電子豊富な多重結合をプラットフォームとする分子変換法の開発
・新しい触媒的不斉合成反応の開発
アレンを基盤とする新しい環状化合物合成法の開発
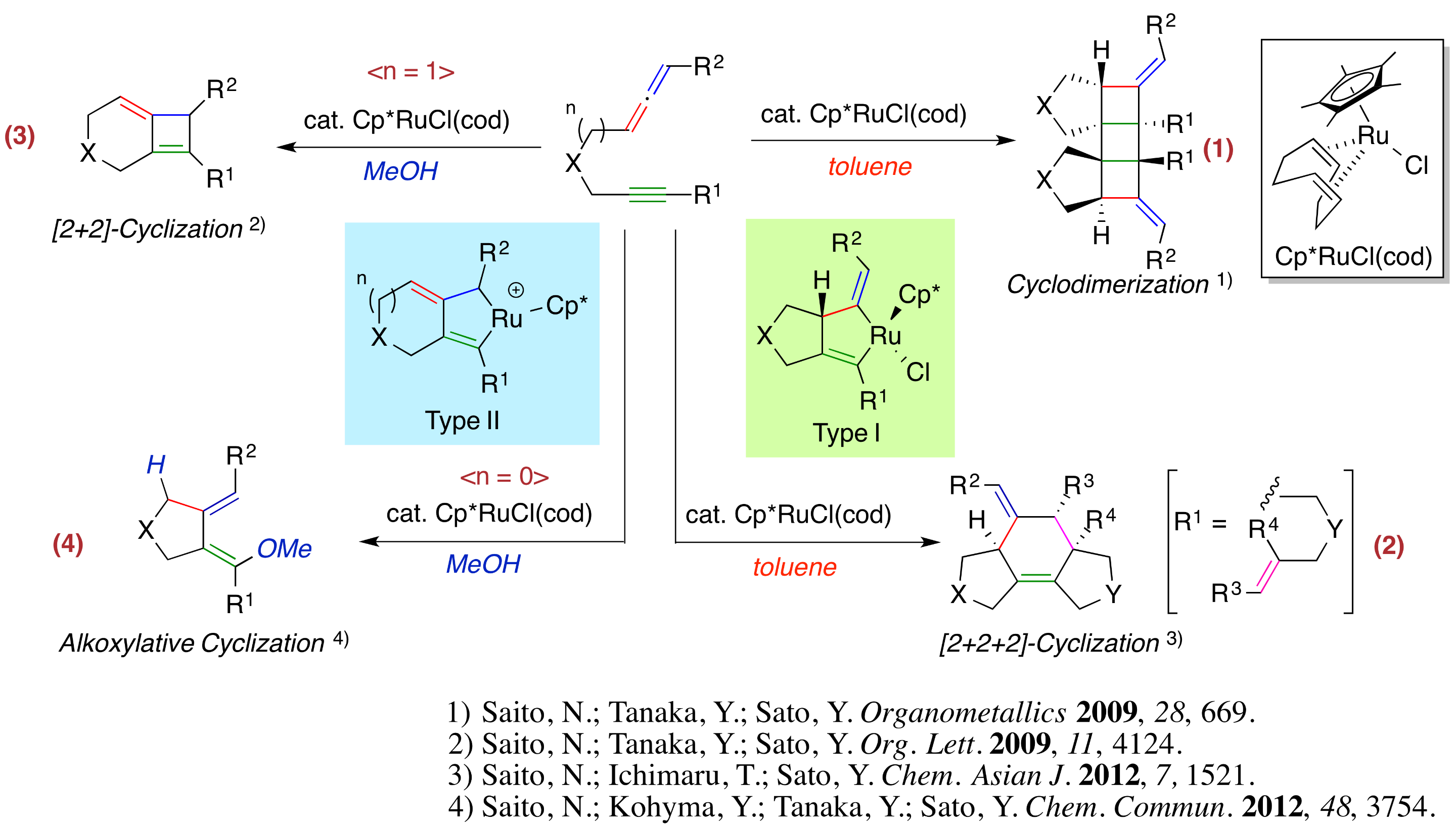
1,2-ジエンであるアレンは分子の中に2つの二重結合部位があることから、どちらの二重結合が反応するかによって異なる生成物が得られる可能性があります。私たちはルテニウム触媒を用いてアレンとアルキンの反応を検討したところ、反応条件を変えるだけで全く異なる骨格を持つ環状化合物を作り分けることに成功しました。
- 1,7-アレンインの環化二量化反応:1,7-アレンインを2価ルテニウム錯体Cp*RuCl(cod)触媒存在下でトルエン中で反応させたところ、アレンの内側の二重結合とアルキンが反応して生成したType Iルテナサイクルを経由し、2つの5員環と3つの4員環が縮環した5環式化合物が単一の立体異性体として得られることを見出しました(反応1)。
- アレン-イン-エンの[2+2+2]環化反応:アルキン上にアルケンテザーを持つアレンインを上記の反応条件に付したところ、[2+2+2]環化反応が進行し、鎖状化合物から一挙に3環式化合物を合成することに成功しました(反応2)。
- [2+2]環化反応への展開:環化二量化反応の検討の途上、溶媒をメタノールに変えるとアルケンの外側の二重結合が反応しType IIルテナサイクルを与え、ビシクロオクタジエン誘導体が生成することを見出しました。本反応では中性の2価ルテニウムからカチオン性の2価ルテニウム錯体が生成していることも明らかにしました(反応3)。
- 求核剤の付加を伴う環化反応:上記の[2+2]環化反応の検討の過程で基質を1,6-アレンインに変えたところ、Type IIルテナサイクルへのメタノールの付加を伴う環化反応が進行し、ビスアルキリデンシクロペンタン誘導体が得られることを見出しました(反応4)
現在これらの反応を利用した天然有機化合物の全合成研究や、新しい骨格を持つ反応素子の開発研究を進めています。
電子豊富な多重結合をプラットフォームとする分子変換法の開発
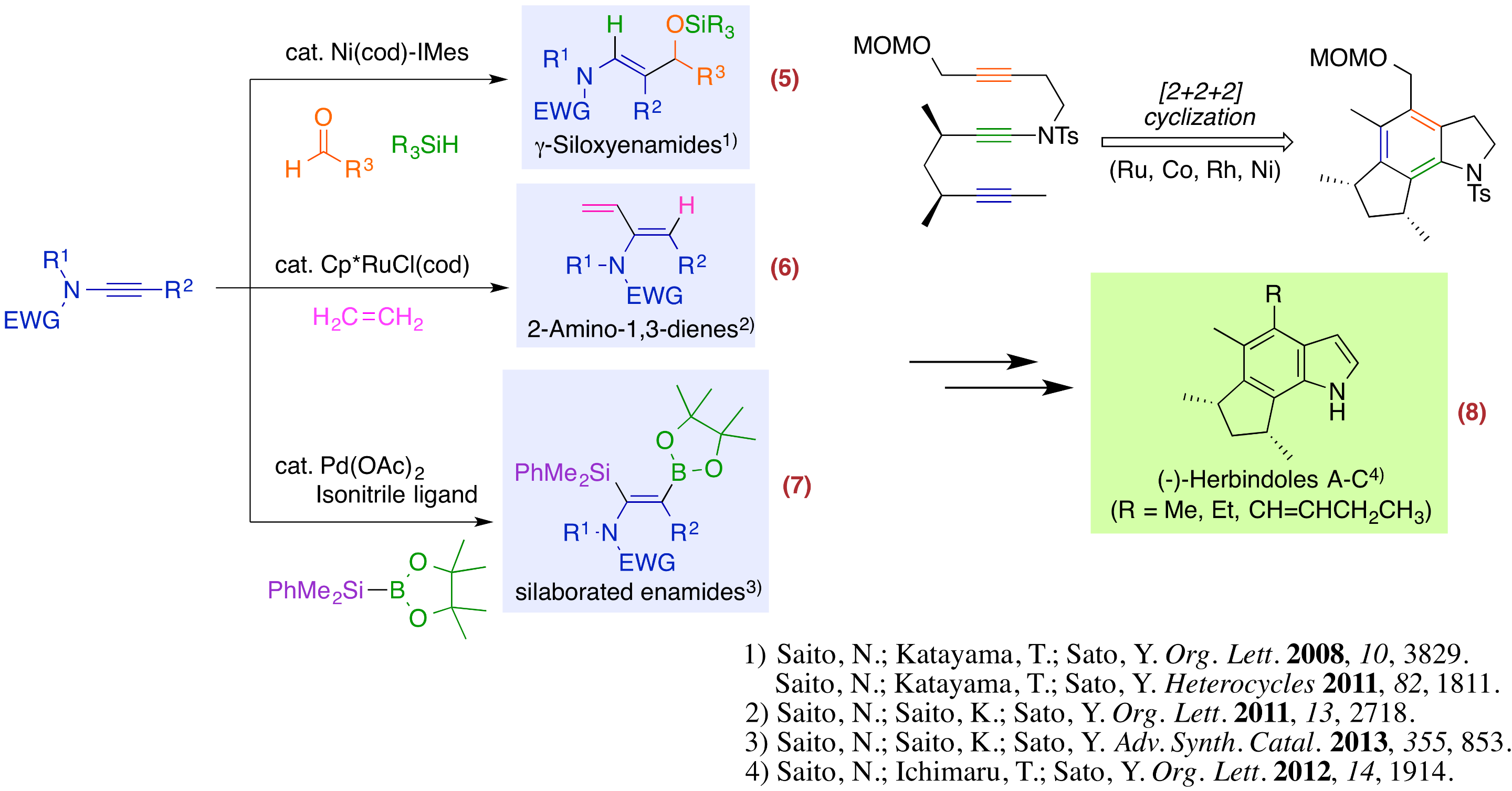
窒素や酸素などのヘテロ原子が直接結合した多重結合は、ヘテロ原子上の非共有電子対が多重結合へ非局在化するため、単純な多重結合性化合物に比べ非常に電子が豊富です。特に、ヘテロ原子のβ位は負の部分電荷を持つため求核性を示します。私たちはこのヘテロ原子が結合した多重結合である、イナミド、アリールオキシアルキンおよびアレナミドをプラットフォームとした分子変換法の開発を進め、多様な化合物を合成することに成功しました。
- イナミドを基盤とする分子変換:ニッケル触媒によるアルデヒドおよびシランとの位置及び立体選択的三成分連結反応によるγ-シロキシエナミド合成法(反応5)、ルテニウム触媒によるエチレンとの形式的ヒドロビニル化による2-アミノ-1,3-ジエン合成法(反応6)、パラジウム触媒による高位置選択的シラホウ素化による多置換エナミド合成法(反応7)の開発に成功しました。また、分子内に2つのアルキン部位を持つイナミドの遷移金属触媒を用いた[2+2+2]環化反応によりインドール骨格を一挙に構築し、さらに 抗腫瘍活性を持つ(-)-Herbindole A、BおよびCの天然体としての初の全合成を達成しました(反応8)。
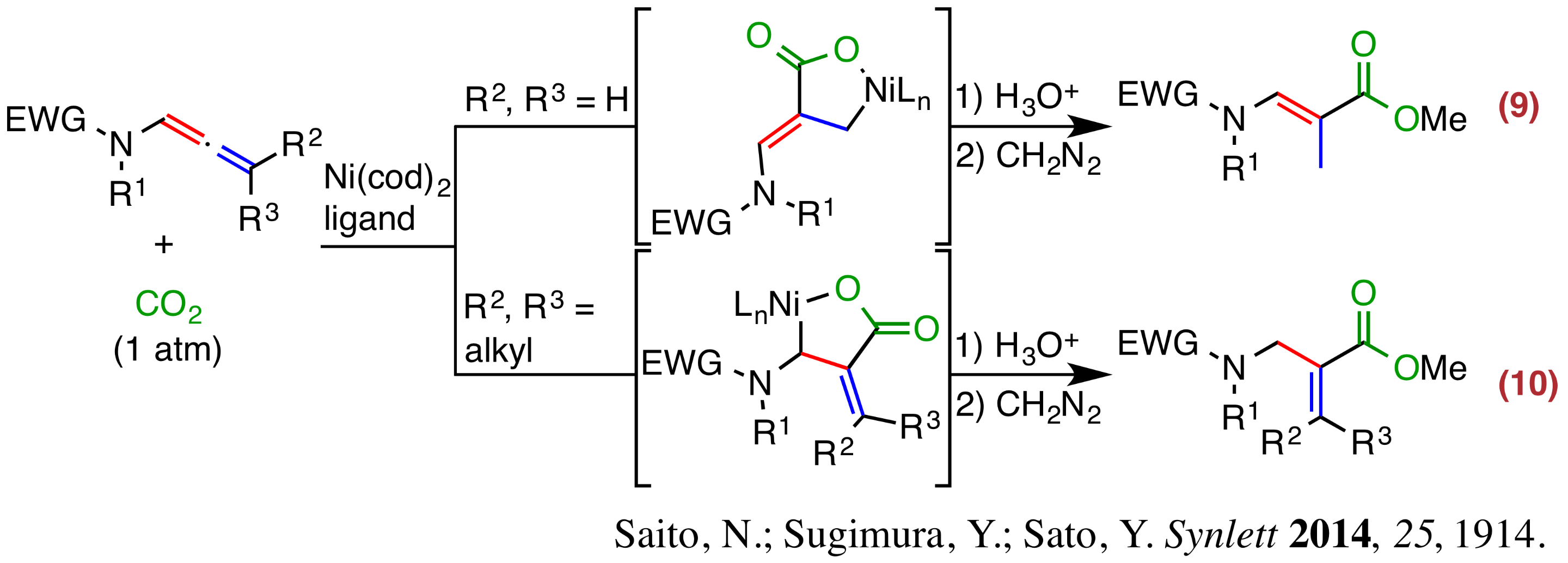
- アレナミドへの位置選択的二酸化炭素固定化反応:0価ニッケル錯体はアルキンやアルケンなどの炭素-炭素多重結合および二酸化炭素と反応しニッケララクトンと呼ばれる錯体を与えることが知られています。私たちは本反応を利用し、窒素原子がアレンの炭素原子に直接結合したアレナミドへの二酸化炭素の固定化反応を開発しました。本反応ではアレン上の置換基によって位置選択性が変化することを明らかにしました(反応9および10)。
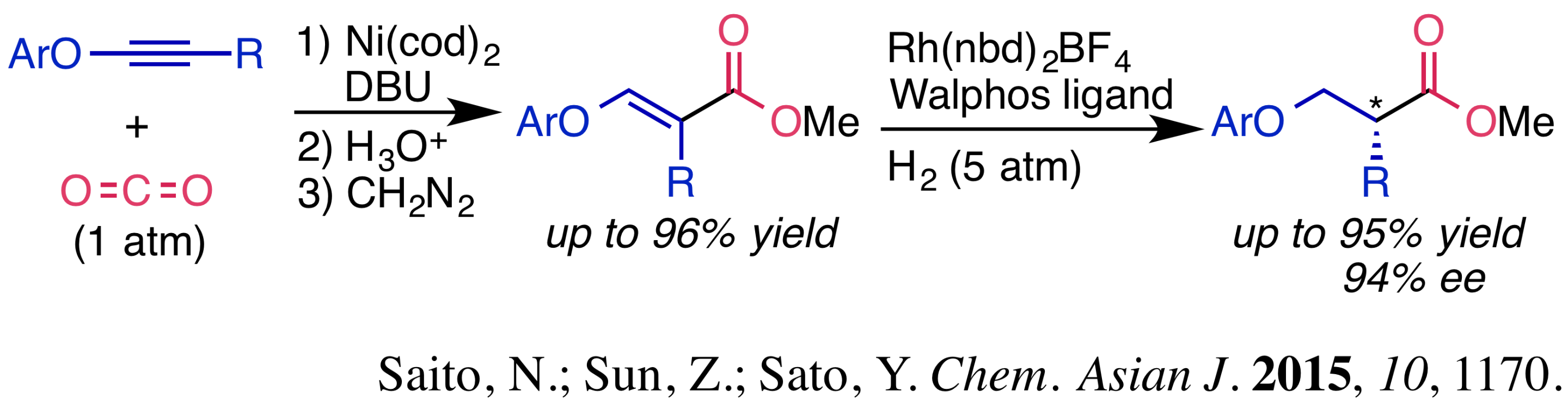
- アリールオキシアルキンへの二酸化炭素固定化を経由するβアリールオキシカルボン酸の不斉合成:上記の0価ニッケル錯体を用いた二酸化炭素固定化反応をアリールオキシアルキンへ適用したところ、高位置選択性でβアリールオキシアクリル酸誘導体を合成することができました。この化合物を基質とし、光学活性ロジウム触媒を用いる不斉水素化反応に付したところ、様々な生物活性化合物の構成ユニットであるβアリールオキシプロピオン酸誘導体を高収率・高エナンチオ選択的に合成することに成功しました。
現在も、特にイナミドをプラットフォームとする触媒的分子変換法の開発研究を進めています。

 HOME
HOME